আসসালামু আলাইকুম । আশা করি সকলে ভালো আছেন । আমিও আলহামদুলিল্লাহ আপনাদের দোয়ায় অনেক ভালো আছি । যাই হোক আমি বেশি কথা বাড়াতে চাই না সরাসরি পোস্টের কথাতে চলে আসতে চায় ।
অনেকেই হয়তো পোস্টের টপিক দেখেই বুঝে ফেলেছেন যে আজ আমি কোন বিষয় নিয়ে লিখতে যাচ্ছি । আজ আমি আপনাদের সাথে বিজ্ঞানের একটি বিষয় [মৌলের ইলেক্ট্রন বিন্যাস] নিয়ে আলোচনা করতে যাচ্ছি । আশা করি সকলে আমার আজকের পোস্ট পড়বেন । ভালো লাগলে লাইক এবং কমেন্ট করবেন ।
এই পবটি ইলেক্ট্রন বিন্যাসের ৫ম এবং শেষ পব । এই পবে ধনাত্মক ও ঋণাত্মক আয়নের ইলেক্ট্রন বিন্যাস শিখব । অন্যান্য পবগুলো যথাক্রমে নিচে দেওয়া হলো ।
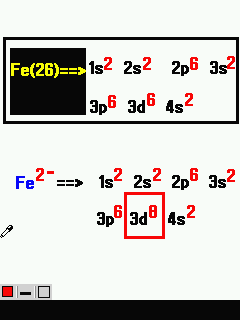
আমরা একটা বিষয় শিখে নিব । ধনাত্মক (+) আয়নে মৌলের ইলেক্ট্রন ইলেক্ট্রন কমে যায় এবং ঋণাত্মক (-) আয়নে ইলেক্ট্রন বেড়ে যায় । যেমন:- আয়রন বা Fe এর ইলেক্ট্রন সংখ্যা 26 । এখন যদি Fe2+ এরকম লেখা হয় তবে ইলেক্ট্রন কমে যাবে । 2+ রয়েছে তাই এর ২টি ইলেক্ট্রন কমে যাবে । অথাৎ 24 টি হবে । আমরা মনে করি প্লাস চিহ্ন রয়েছে বলে হয়তো বেড়ে যাবে । কিন্তু না । আসলে বাড়ে না বরং কমে যায় । আর মাইনাস চিহ্ন থাকলে বেড়ে যাবে । এখন এটির ইলেক্ট্রন বিন্যাস শিখব ।
প্রথমে এই Fe2+(26) দিয়েই শেখা যাক । এজন্য প্রথমে আমরা Fe(26) এর ইলেক্ট্রন বিন্যাস করে নিব ।

এখন যে বিষয়টি আমরা দেখব সেটি ইলেক্ট্রন কতটি কমবে । 2+ রয়েছে তাই দুটি কমবে । অথাৎ 24 টি হবে ।
আমাদেরকে মনে রাখতে হবে যে ধনাত্মক আয়নে ইলেক্ট্রন শেষ কক্ষপথের শেষ অরবিটাল থেকে ত্যাগ করে । মনে রাখতে হবে শেষ অরবিটাল থেকে যাবে না । আবার 24টি ইলেক্ট্রনের বিন্যাস করলেই হবে না । শেষ কক্ষপথের শেষ অরবিটাল থেকে ইলেক্ট্রন কমিয়ে দিতে হবে ।
আয়রনের শেষ কক্ষপথের শেষ অরবিটাল 4s । অথাৎ 4s থেকে দুটি কমিয়ে দিতে হবে । দেখা যাবে যে 4s এ কোন ইলেক্ট্রনই থাকবে না । তাই 4s লিখবও না ।

আবার ঋণাত্মক আয়নে ইলেক্ট্রন শেষ অরবিটালে যুক্ত হবে । শেষ কক্ষপথে নয় । যেমন Fe2- এর ক্ষেত্রে শেষ অরবিটাল 3d । অথাৎ 3d তে যুক্ত হবে ।
তো আজ এতটুকুই ছিল । সবাইকে ধন্যবাদ ।
The post সকল মৌলের ইলেক্ট্রন বিন্যাস শিখুন সহজে [৫ম ও সবশেষ পব] appeared first on Trickbd.com.
from Trickbd.com https://ift.tt/f5tVnp2
via IFTTT
No comments:
Post a Comment